服务热线
178 0020 3020
本期研究
1. 古代和现代基因组揭示了犀牛家族的进化史
2. 双膜状细胞器实现正交真核翻译的空间分离
3. 招募效应蛋白的平行途径决定着丝粒驱动和抑制
4. AAV 衣壳变体家族的定向进化使跨物种的有效肌肉定向基因传递成为可能
5. 美国出现早期 SARS-CoV-2 流行病
6. 沿呼吸道的干扰素景观影响 COVID-19 的严重程度
7. 用于识别进化中的 SARS-CoV-2 尖峰的记忆 B 细胞库
8. 免疫刺激性 RNA RN7SL1 使 CAR-T 细胞能够增强自主和内源性免疫功能
9. 抗原优势层次塑造肿瘤中的 TCF1 +祖细胞 CD8 T 细胞表型
10. ILC3s 的失调释放结肠癌的进展和免疫治疗抵抗
封面:只剩下五种曾经不同的犀牛在本期杂志中,Liu等人(4874-4885)分析了所有五种现存和三种已灭绝的犀牛物种的全基因组,以更好地了解曾经多样化的犀牛科的进化历史。他们的研究结果表明,虽然低遗传多样性可能是家庭的一个长期特征,但最近人为驱动的人口减少可能加剧了这种情况,这使人们质疑犀牛将来会如何表现。封面描绘了犀牛物种的主要系统发育进化枝。
1. 古代和现代基因组揭示了犀牛家族的进化史
Ancient and modern genomes unravel the evolutionary history of the rhinoceros family
曾经多样化的犀牛科只剩下五种,这使得重建它们的进化历史成为自达尔文以来生物学家面临的挑战。我们对五种犀牛物种(三种已灭绝和两种现存)的基因组进行了测序,并将其与来自其余三种现存物种和一系列外群的现有数据进行了比较。我们确定了现存非洲和欧亚血统之间的早期分歧,解决了关于现存犀牛系统发育的关键争论。这个早期的中新世(约 1600 万年前 [mya])在非洲-阿拉伯和欧亚大陆之间的陆桥形成之后分裂。我们的分析还表明,虽然犀牛基因组总体上表现出低水平的全基因组多样性,但现代物种的杂合度最低,近亲繁殖最高。
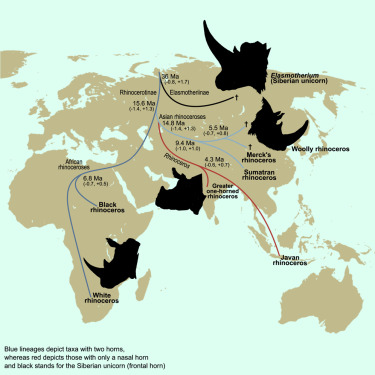
2. 双膜状细胞器实现正交真核翻译的空间分离
Dual film-like organelles enable spatial separation of orthogonal eukaryotic translation
通过酶进化或从头将新功能设计到活的真核系统中蛋白质设计是一项艰巨的挑战。细胞并不完全依赖基于 DNA 的进化来产生新的功能,而是经常利用膜封装或无膜细胞器的形成来分离执行复杂操作的不同分子过程。应用这一原理和二维相分离的概念,我们开发了膜状合成细胞器,支持各种细胞膜表面的蛋白质翻译。这些亚分辨率合成薄膜提供了在同一细胞内制造功能不同的酶的途径。我们使用这些薄膜状细胞器为真核细胞配备双正交扩展遗传密码,从而能够以单残基精度对不同的翻译机器进行特定的重新编程。
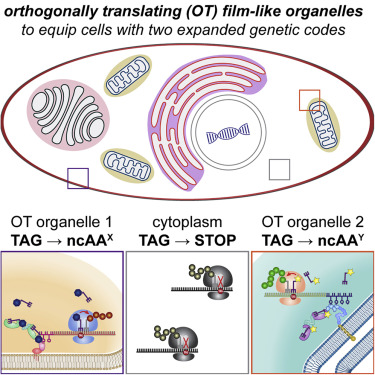
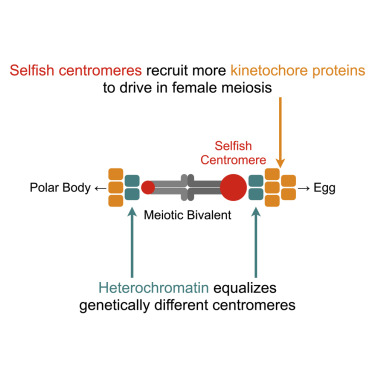
3. 招募效应蛋白的平行途径决定着丝粒驱动和抑制
Parallel pathways for recruiting effector proteins determine centromere drive and suppression
自私的着丝粒 DNA 序列偏向于它们在雌性减数分裂中向卵的传递。进化理论表明,着丝粒蛋白质进化以抑制这种“着丝粒驱动”的成本。在具有基因不同的母本和父本着丝粒的杂交小鼠模型中,自私的着丝粒 DNA 利用动粒途径来招募充当驱动效应器的微管不稳定蛋白质。我们表明,这种功能差异受到异染色质效应子募集的平行途径的抑制,这在该系统中的着丝粒之间是相似的。用不同的 CENP-C 等位基因破坏动粒通路可减少着丝粒之间的功能差异,而通过 CENP-B 缺失破坏异染色质会放大差异。使用 Murinae 基因组的分子进化分析确定了两种途径中蛋白质的适应性进化。我们提出着丝粒蛋白质反复进化以最小化自私DNA利用的着丝粒途径,相对于平衡着丝粒的异染色质途径,同时保持基本功能。
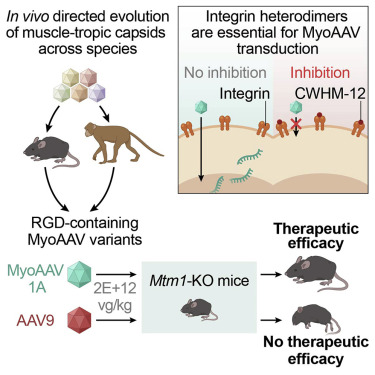
4. AAV 衣壳变体家族的定向进化使跨物种的有效肌肉定向基因传递成为可能
Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species
替换或编辑致病突变为治疗许多人类疾病带来了巨大希望。然而,在体内向特定细胞递送治疗性遗传修饰剂一直具有挑战性,尤其是在解剖学上分布的大型组织(如骨骼肌)中。在这里,我们建立了一个体内进化并严格选择腺相关病毒 (AAV) 的衣壳变体的策略,这些变体能够有效地递送至所需组织。使用这种方法,我们确定了一类含有 RGD 基序的衣壳,其在小鼠和非人类灵长类动物中静脉注射后以优异的效率和选择性转导肌肉。在两种遗传性肌肉疾病小鼠模型中,我们证明了与天然存在的 AAV 衣壳相比,这些工程载体的效力和治疗功效显着增强。我们的选择方法中的顶级衣壳变体显示出在各种近交小鼠品系以及食蟹猴和人类原代肌管中传递的保守效力,转导依赖于靶细胞表达的整合素异二聚体。
8. 免疫刺激性 RNA RN7SL1 使 CAR-T 细胞能够增强自主和内源性免疫功能
The immunostimulatory RNA RN7SL1 enables CAR-T cells to enhance autonomous and endogenous immune function
肿瘤浸润不良、衰竭发展和抗原不足是限制嵌合抗原受体 (CAR)-T 细胞功效的常见机制。递送模式识别受体激动剂是改善免疫功能的一种策略;然而,将这些激动剂靶向免疫细胞具有挑战性,并且癌细胞中的脱靶信号可能是有害的。在这里,我们设计 CAR-T 细胞以传递 RN7SL1,这是一种激活 RIG-I/MDA5 信号的内源性 RNA。RN7SL1 促进 CAR-T 细胞的扩增和效应记忆分化。此外,RN7SL1 被部署在细胞外囊泡中并选择性地转移到免疫细胞。与其他 RNA 激动剂不同,转移的 RN7SL1 限制了髓源性抑制细胞 (MDSC) 的发育,减少骨髓细胞中的 TGFB,并促进具有共刺激特征的树突状细胞 (DC) 亚群。因此,内源性效应记忆和肿瘤特异性 T 细胞也会扩增,从而排斥具有 CAR 抗原丢失的实体瘤。在改善的内源性免疫的支持下,CAR-T 细胞现在可以与 RN7SL1 共同部署肽抗原以提高疗效,即使在异源 CAR 抗原肿瘤缺乏足够的新抗原时也是如此。

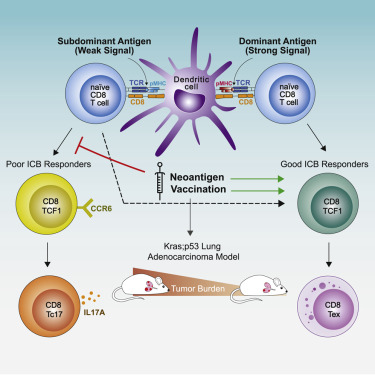
9.抗原优势层次塑造肿瘤中的 TCF1 +祖细胞 CD8 T 细胞表型
Antigen dominance hierarchies shape TCF1+ progenitor CD8 T cell phenotypes in tumors
针对不同肿瘤新抗原的 CD8 T 细胞反应同时发生,但对反应之间的相互作用及其对 T 细胞功能和肿瘤控制的影响知之甚少。在小鼠肺腺癌中,我们发现在肿瘤中建立了免疫优势,其中 CD8 T 细胞扩增主要由最稳定地结合 MHC 的抗原驱动。对亚优势抗原有反应的 T 细胞富集了与免疫检查点阻断 (ICB) 治疗反应相关的 TCF1 +祖细胞表型。然而,由于 TCF1 +功能失调的亚群,亚优势 T 细胞反应并没有优先受益于 ICB以 CCR6 和 Tc17 分化为标志的细胞。对人类样本和测序数据集的分析表明,CCR6 + TCF1 +细胞存在于人类癌症中,并且与 ICB 反应无关。疫苗接种消除了 CCR6 + TCF1 +细胞并显着改善了亚显性反应,突出了一种最佳地参与针对肿瘤的并发新抗原反应的策略。
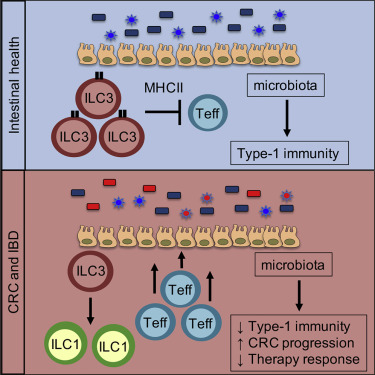
10. ILC3s 的失调释放结肠癌的进展和免疫治疗抵抗
Dysregulation of ILC3s unleashes progression and immunotherapy resistance in colon cancer
第 3 组先天淋巴细胞 (ILC3) 调节免疫和炎症,但它们在癌症中的作用仍然难以捉摸。在这里,我们发现结直肠癌 (CRC) 表现为改变的 ILC3,其特征是频率降低、可塑性增加和 T 细胞不平衡。我们在小鼠中评估了这些变化的后果,并确定 ILC3s 和 T 细胞之间通过 II 类主要组织相容性复合体 (MHCII) 进行对话对于支持微生物群定植是必要的,这些微生物群随后在肠道和肿瘤微环境中诱导 1 型免疫。因此,缺乏 ILC3 特异性 MHCII 的小鼠会发展为侵袭性 CRC,并对抗 PD-1 免疫疗法产生耐药性。最后,肠道 ILC3s 失调的人含有微生物群,当转移到小鼠身上时,这些微生物群不能诱导 1 型免疫和免疫治疗反应。总的来说,这些数据定义了 ILC3s 在癌症中的保护作用,并表明它们在 CRC 中的固有破坏会导致适应性免疫功能失调、肿瘤进展和免疫治疗抵抗。
https://www.cell.com/cell/issue?pii=S0092-8674(20)X0020-1
附件