服务热线
178 0020 3020
限制性内切酶克隆(Restriction Cloning)是一种常见的克隆技术,其中限制性内切酶(Restriction Enzymes)用于准备连接的插入物(Insert)和载体(Vector),如下图,
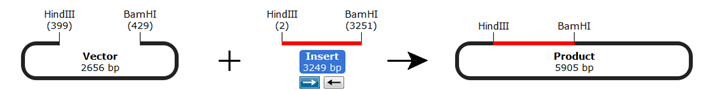
SnapGene提供了一个模拟限制性克隆的直观界面。可以提前设想一个试验流程,这样在SnapGene上模拟只需要几秒钟就能搞定。快速发现克隆过程是否存在设计缺陷,并在真正试验进行前纠正它们。
限制性克隆有哪些技巧? 限制性克隆虽然传统,但在很多应用场景中,它仍然是最好的方法之一。下面介绍一些基本技巧,会帮助你的克隆更顺利地进行。 General Tricks
首先,也是最重要的是,进行的每一步都要小心谨慎。从长远来看,这会节省很多时间(避免从头来过);
确保DNA非常干净。当准备载体或切除要插入的片段时,从大约2μg的DNA开始;
每次酶促反应后,用离心柱(spin-column)纯化DNA。在40 – 45μl的10 mM Tris(pH 8.5)中洗脱DNA,然后进行下一步反应;(注意,在用凝胶纯化DNA片段之前,不需要使用离心柱)
为了使效率最大化,建议设计流程时尽量减少步骤。例如,将钝端片段克隆到钝端载体上,如SmaI位点,比克隆到用Klenow或T4 DNA聚合酶钝化的位点效果更好;
在你不能肯定的时候,先用用凝胶提纯DNA片段。更纯净的原材料往往能产生更好的结果;
About Preparing the Vector
限制克隆最常见的问题是,起始载体(starting vector)会在过程之后恢复。出现这个问题有两个原因:1)载体的不完全消化;2)切割后的载体与自身再链接(re‑ligation)。下面要介绍的技巧会帮助你最小化这些影响。
确保载体的消化完成。使用过量的限制酶(2μgDNA,约20 U),并消化约4小时。如果需要使用具有不同最佳反应缓冲液的两种酶切割载体,依次进行消化,并在两者之间进行离心柱(spin-column)纯化;
消化载体后(如需可blunting),然后用磷酸酶处理:在37°C下1小时5'overhangs,或在50°C下1小时,如果DNA有钝端或3'overhangs;
用离心柱除去磷酸酶(phosphatase)。通常不需要对载体进行凝胶纯化,因为磷酸酶处理将使产生的任何额外DNA片段失活;
*利用载体,确保消化和磷酸酶反应完成。将混合物彻底反复涡旋(vortex),使任何微滴都无法逃脱酶处理。涡旋后短暂旋转是一个好主意,以确保在管子的侧面上没有残留。
About Preparing the Inserted Fragment
对于插入片段的制备,“不完全消化”并不是一个严重的问题,因为片段的部分恢复是可以接受的。你可以使用相对较短的消化时间,对于双重消化,可以使用对一种或两种酶都不理想的反应缓冲液;
用凝胶纯化插入的片段。除了去除不需要的或不完全消化的DNA外,这个过程还去除了酶和小分子。用透照器观察DNA条带时,不要使用312 nm或以下的短波紫外线光,否则DNA会受到严重破坏。建议使用360-365 nm紫外线光;
如果插入的片段是通过PCR产生的,在进行任何限制酶切消化之前,需要先用凝胶或离心柱将其纯化。如果打算将钝端PCR片段(由聚合酶生成,如Pfu)克隆到经过磷酸酶处理的载体中,要确保PCR引物含有5'-磷酸(5′-phosphates);
About Ligation and Transformation
用磷酸酶处理的载体进行对照连接,其中插入的片段被省略。这种对照连接应产生很少的转化子(transformants),因为只有环状DNA分子才能有效地转化大肠杆菌(E.coli),如果不与磷酸化片段连接,载体的重新环化就不会发生;
如果DNA仅具有粘性末端,在室温下连接~1小时左右。如果DNA有钝端,在室温下连接4小时左右,同时使用高浓度T4连接酶(high-concentration T4 ligase);
About Minipreps and Diagnostic Digest
如果与插入片段的连接所获得的转化子多于对照连接,那么几乎可以说克隆将正常进行,通常只需进行3-4次小量制备即可;
对小量制备进行诊断限制性消化时,要始终将起始载体包括在内作为参考标准;
附件