服务热线
178 0020 3020
本期导读【Volume 39, Issue 5, May 10, 2021】
1.肾细胞癌进展期免疫功能紊乱
2.晚期肾癌免疫治疗中的肿瘤与免疫重编程
3.单细胞测序将ccRCC中的多区域免疫景观和组织驻留T细胞与肿瘤拓扑结构和治疗效果联系起来
4.癌细胞通过NRF2诱导的巨噬细胞吞噬逃避自噬抑制
5.致癌的染色体外DNA作为移动增强子在染色体转录中发挥作用
6.肠道血管屏障损伤导致肠道细菌扩散和结直肠癌肝转移

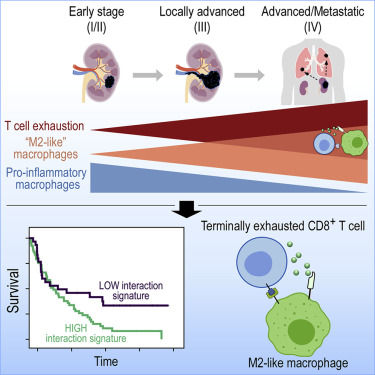
封面:单细胞转录组分析揭示肾细胞癌(RCC)复杂的肿瘤免疫微环境,揭示形成肿瘤“免疫回路”的细胞相互作用。Braun等人证明,耗竭的CD8+T细胞和M2样巨噬细胞在晚期疾病中富集,并相互作用形成与预后较差相关的免疫功能障碍回路。在两个相关的研究中,Bi等人(第649-661页)和Krishna等人(第662-677页)在免疫检查点阻断疗法的背景下定义了肾细胞癌的免疫景观。
1. 肾细胞癌进展期免疫功能紊乱
Progressive immune dysfunction with advancing disease stage in renal cell carcinoma
肿瘤免疫微环境在肾透明细胞细胞癌(ccRCC)的肿瘤进展和免疫治疗反应中起着重要作用,但其免疫细胞的组成和表型尚不完全清楚。作者对164722个来自肿瘤和邻近非肿瘤组织的单个细胞进行了single-cell-RNA和T细胞受体测序,这些细胞来自不同疾病阶段的ccRCC患者:早期、局部晚期和晚期/转移。晚期耗竭的CD8+T细胞在转移性疾病中富集,并且在T细胞受体多样性方面受到限制。在髓样腔内,炎症前巨噬细胞减少;而在晚期疾病中抑制性M2样巨噬细胞增加。终末衰竭的CD8+T细胞和M2样巨噬细胞共同出现在晚期疾病中。这种免疫功能障碍回路与外部队列中的不良预后相关,并确定了ccRCC中潜在的靶向免疫抑制途径。
2. 晚期肾癌免疫治疗中的肿瘤与免疫重编程
Tumor and immune reprogramming during immunotherapy in advanced renal cell carcinoma
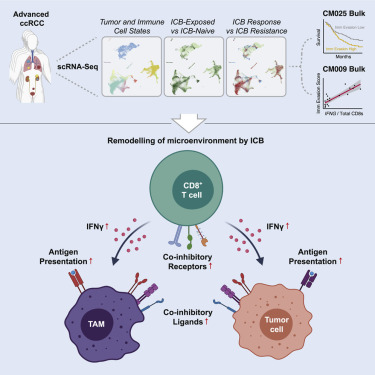
免疫检查点阻断(ICB)可使一部分晚期肾细胞癌(RCC)患者获得持久的疾病控制,但其耐药机制尚不清楚。作则对ICB暴露前后转移性RCC患者肿瘤和免疫细胞的单细胞转录组进行了研究。在应答者中,细胞毒性T细胞亚群表达更高水平的协同抑制受体和效应分子。在富含干扰素的微环境作用下,治疗后活检组织中的巨噬细胞向促炎状态转变,但同时也上调免疫抑制标记物。在癌细胞中,作者将其分为两个亚群,两个亚群在血管生成信号传导和ICB后免疫抑制程序的上调方面存在差异。癌细胞亚群的表达特征和免疫逃避与原发性和ICB治疗的晚期RCC中PBRM1突变和生存相关。作者的研究结果表明,ICB重塑了RCC的微环境,并改变了肿瘤和免疫细胞群之间的相互作用,这对于理解ICB的应答和耐药性至关重要。
3. 单细胞测序将ccRCC中的多区域免疫景观和组织驻留T细胞与肿瘤拓扑结构和治疗效果联系起来。
Single-cell sequencing links multiregional immune landscapes and tissue-resident T cells in ccRCC to tumor topology and therapy efficacy
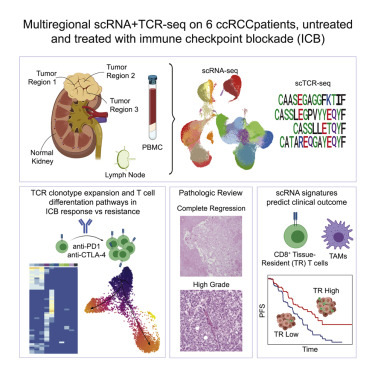
肾透明细胞癌(ccRCCs)具有高度的免疫浸润性,但免疫异质性对ccRCCs临床预后的影响尚未完全阐明。在这里,作者对来自2例未经免疫检查阻断剂治疗和4例经过治疗的多个肿瘤区域、淋巴结、正常肾脏和外周血的167283个细胞进行配对单细胞RNA(scRNA)和T细胞受体(TCR)测序并绘制ccRCC免疫图。作者检测到患者内部和患者之间存在广泛的异质性,对ICB有反应的患者体内CD8A+组织驻留T细胞富集,耐药患者体内肿瘤相关巨噬细胞(TAMs)富集。TCR轨迹框架表明,对ICB有反应和耐药的患者之间存在不同的T细胞分化途径。最后,在多个独立队列中,组织驻留T细胞和TAM的scRNA衍生特征与ICB和靶向治疗的反应相关。作者的研究建立了对ccRCC治疗效果细胞层面的多方面改变。
4. 癌细胞通过NRF2诱导的巨噬细胞吞噬逃避自噬抑制
Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis
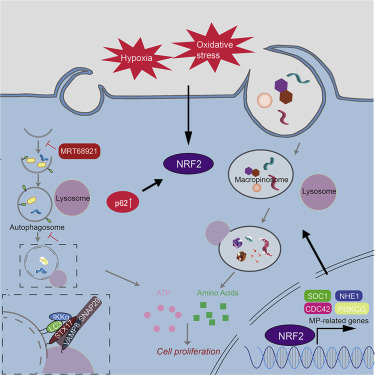
许多癌症,包括胰腺导管腺癌(PDAC),依赖于自噬介导的细胞内大分子的清除和再循环,提示自噬阻断可能导致肿瘤饥饿和消退。然而,迄今为止,抑制自噬的单一疗法还没有显示出有效的抗癌活性。作者的研究表明,自噬阻断促使PDAC上调并利用另一种营养物质获取途径:大胞浆细胞增多症(macropinocytosis,MP),它允许肿瘤细胞从细胞外来源提取营养物质并利用它们产生能量。自噬到MP的开关(可能在进化上是保守的,而不是局限于癌细胞)依赖于自噬适配器p62/SQSTM1对转录因子NRF2的激活。致癌突变、缺氧和氧化应激引起的NRF2活化也导致MP上调。在自噬受损的PDAC中抑制MP可引起移植性和原位肿瘤的代谢显著下降和消退,提示自噬和MP抑制剂联合应用在临床上的治疗前景。
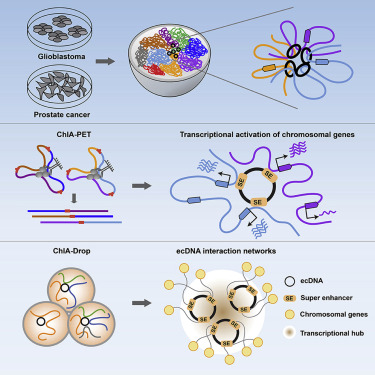
5. 致癌的染色体外DNA作为移动增强子在染色体转录中发挥作用
Oncogenic extrachromosomal DNA functions as mobile enhancers to globally amplify chromosomal transcription
染色体外环状DNA(ecDNA)是肿瘤基因组中一种普遍存在但特征不明显的致癌改变。作者利用ChIA-PET和ChIA-Drop染色质相互作用分析来表征影响癌症转录程序的全基因组ecDNA介导的染色质接触。胶质母细胞瘤患者来源的神经球和前列腺癌细胞培养中的ecDNA具有广泛的ecDNA内和全基因组染色体相互作用。ecDNA染色质接触灶的特点是广泛和高水平的H3K27ac信号主要集中在表达水平增加的染色体基因上。前列腺癌细胞含有由特征性增强子组成的合成ecDNA环,导致染色体基因转录的全基因组激活。在单分子分辨率下破译ecDNA的染色体靶点揭示了与ecDNA定向相互作用网络中空间聚集的活性与癌基因表达的关联。作者的研究结果表明ecDNA可以作为移动的转录增强子来促进肿瘤的进展,并显示了一种潜在的合成非整倍体的转录调控机制。
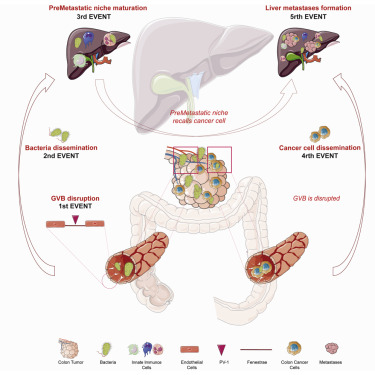
6,肠道血管屏障损伤导致肠道细菌扩散和结直肠癌肝转移
Gut vascular barrier impairment leads to intestinal bacteria dissemination and colorectal cancer metastasis to liver
转移是由一个“转移前生态位”的形成而促进的,这个生态位是由原发性肿瘤衍生因子培育的。结直肠癌主要转移到肝脏。作者发现肝脏转移前的生态位是由原发性结直肠癌的细菌传播引起的。作者报道肿瘤驻留细菌大肠杆菌破坏肠道血管屏障(GVB),这是一种控制细菌沿着肠肝轴传播的解剖结构,依赖于毒力调节因子VirF。当GVB受损时,细菌扩散到肝脏,促进转移前生态位的形成,并有利于转移细胞的募集。在大肠癌患者的训练和验证队列中,作者发现PV-1(GVB受损的标志物)水平升高与肝细菌播散和异时性远处转移有关。因此,PV-1是大肠癌远处复发和血管损害的预后标志物,可导致肝转移。
附件