Communications Biology | 复旦大学李继喜/赵国屏团队合作解析结核分枝杆菌EF-Tu的结构基础及分子机制
李继喜/赵国屏团队合作解析结核分枝杆菌EF-Tu的结构基础及分子机制
2022年10月3日,国际学术期刊《Communications Biology》在线发表了复旦大学生命科学学院李继喜教授课题组与中科院植物生理生态研究所赵国屏院士团队的合作研究成果“Structural insights of the elongation factor EF-Tu complexes in protein translation of Mycobacterium tuberculosis”。研究团队首次解析了结核分枝杆菌延伸因子EF-Tu结合GDP及EF-Ts的三维结构,揭示了EF-Tu在氨基酰-tRNA转运过程中的构象变化及激活机制;发现非小细胞肺癌治疗药物Osimertinib与EF-Tu直接结合,并显著抑制结核分枝杆菌和BCG的生长,为抗结核药物的研发提供了新的视角。
结核病是由结核分枝杆菌(Mycobacterium Tuberculosis)感染引起的一类传染性疾病。当前由于抗生素的滥用,使得结核杆菌的耐药性不断提升。结核病对于中低等发展中国家的危害日益严重,由此造成的经济损失以及家庭负担使得对于新型的抗结核杆菌药物的研发需求迫在眉睫。Elongation Factor-Tu(EF-Tu)作为翻译延伸因子,参与多肽链合成中氨基酰-tRNA的转运工作。由于EF-Tu的编码基因tuf在结核分枝杆菌内为单拷贝,且EF-Tu是唯一可以转运氨基酰-tRNA的蛋白因子;该基因的功能缺失会造成菌株的生长、繁殖受损。但是结核分枝杆菌来源EF-Tu在蛋白质翻译过程中发挥功能的分子基础并不清楚,如何靶向于EF-Tu开发抗结核药物也存在很大挑战。
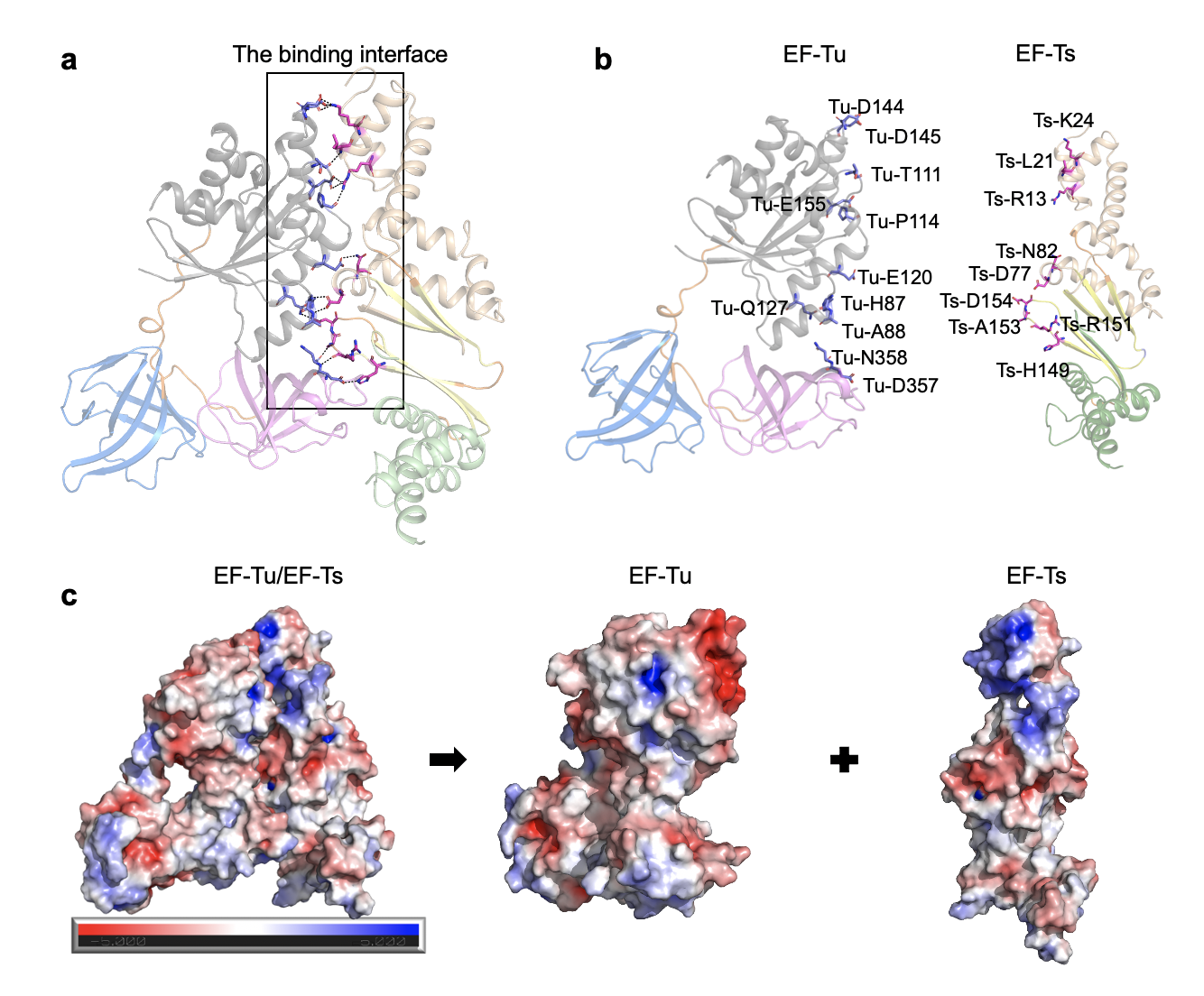
图1. 结核分枝杆菌EF-Tu/EF-Ts复合物三维结构
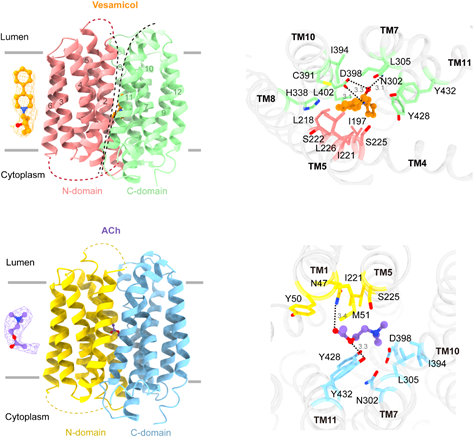
基于此,研究团队首次解析了结核分枝杆菌EF-Tu与GDP及相互作用蛋白EF-Ts复合物的三维结构,揭示了EF-Tu在非活性状态及激活状态下的构象改变机制。基于ITC、SAXS和定点突变实验结果,发现结核分枝杆菌EF-Tu/EF-Ts复合物具有与其他细菌不同的激活方式。体外采用nanoDSF高通量筛选,成功鉴定到多个可以改变EF-Tu热稳定性的小分子药物。其中,Osimertinib明显抑制结核杆菌无毒株H37Ra,耻垢分枝杆菌以及卡介苗(BCG)的生长活性,但无法抑制大肠杆菌的生长。这些工作为研究结核分枝杆菌蛋白质翻译的作用机制提供了分子基础,并启发了对抗结核药物筛选的新思路。
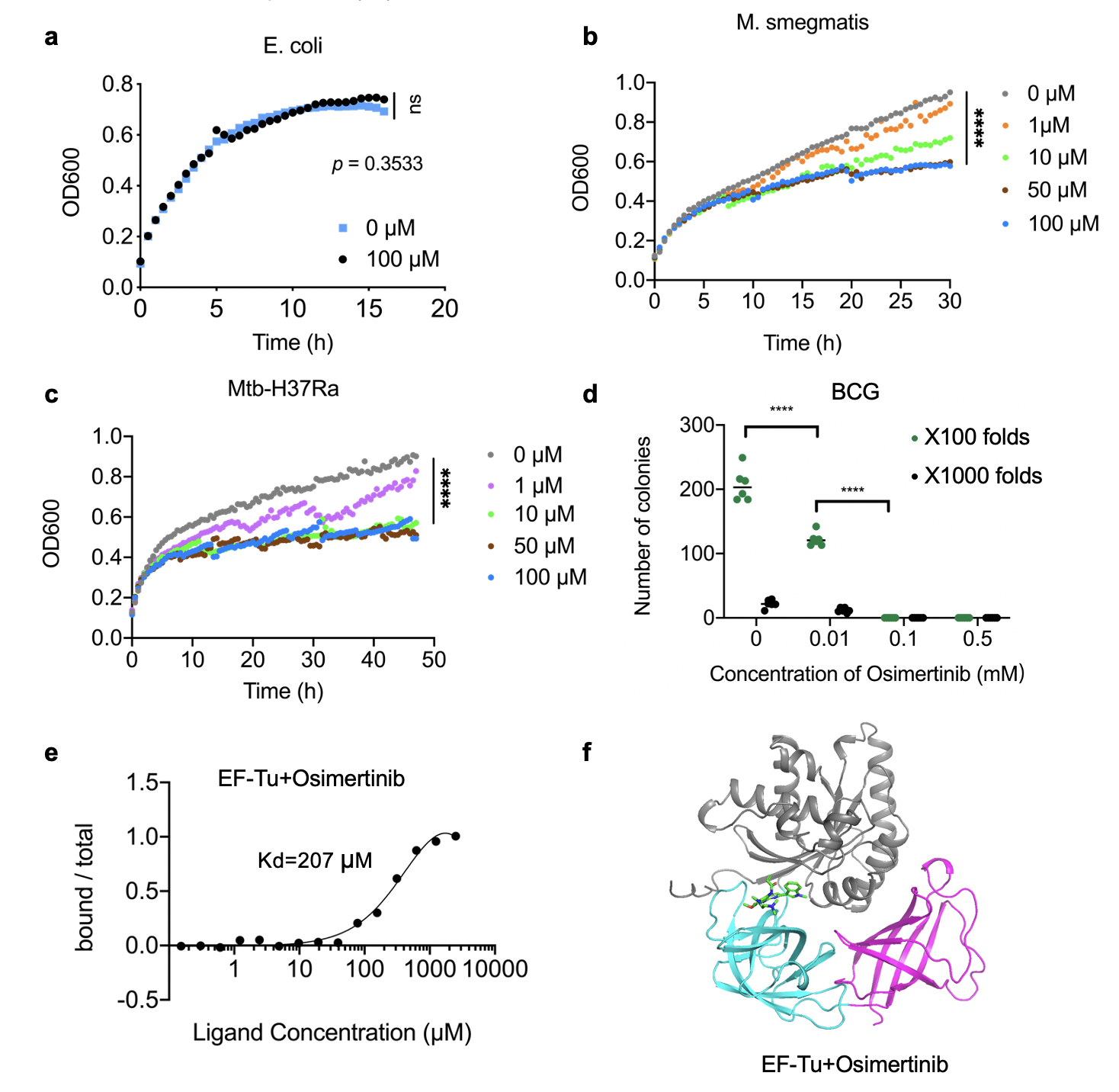
图2.Osimertinib结合EF-Tu并抑制分枝杆菌的生长
复旦大学生命科学学院战博闻博士为论文第一作者,李继喜教授和赵国屏院士为论文共同通讯作者。该项研究工作得到科技部国家重点研发计划和国家自然基金委的资助。
原文链接:https://www.nature.com/articles/s42003-022-04019-y