Autotaxin(ATX)是由ENPP2基因编码的分泌型糖蛋白,是胞外溶血磷脂酸(LPA)产生的关键酶。LPA 作为一种生物活性脂类,作用于细胞膜表面的LPA 受体(LPA1-6),激活多种胞内信号通路,并调控增殖、迁移和侵袭等细胞活动。ATX-LPA 轴在肿瘤发生发展中发挥关键作用,被认为是肿瘤治疗的靶点。人们对ATX表达的调控机制尤其是表观遗传调控机制仍知之甚少,因此探究ATX表达的表观遗传调控机制,对全面了解肿瘤发生发展和研发肿瘤治疗新策略具有重要意义。
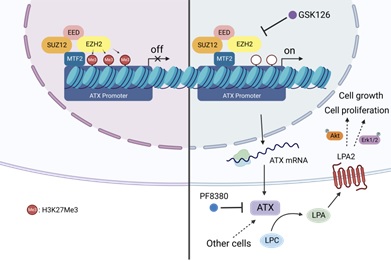
PRC2复合体由四种核心亚基EZH2、SUZ12、EED、RBAP46/RBAP48 组成,可以催化组蛋白H3第27位赖氨酸的三甲基化(H3K27me3),从而参与基因的转录抑制,是重要的表观遗传调控机制之一。EZH2是PRC2中发挥催化活性的关键亚基,EZH2的功能异常与癌症发生、肿瘤免疫及耐药性有关。多种 EZH2 抑制剂已被用来进行临床试验,并表现出有效的抗肿瘤作用,然而EZH2抑制剂对结肠癌肿瘤的抑制效果较为有限。
2023年5月24日,北京师范大学生命科学学院张俊杰教授团队在Cancer Letters在线发表了题为“Combined inhibition of EZH2 and the autotaxin-LPA-LPA2 axis exerts synergistic antitumor effects on colon cancer cells”的研究论文。该研究发现,在结肠癌临床样本中EZH2与ATX的表达水平呈负相关;进一步的研究表明EZH2/PRC2通过在ATX启动子上催化H3K27me3的形成来抑制ATX的表达,且这一过程是通过MTF2的招募EZH2/PRC2来实现。体外和体内实验表明,EZH2抑制剂和ATX抑制剂的联合使用可以显著抑制结肠癌肿瘤细胞的增殖,且LPA2的敲除增强结肠癌肿瘤细胞对EZH2抑制剂的敏感性。该研究阐释了EZH2/PCR2介导的ATX表观遗传调控新机制,揭示了共同靶向EZH2和ATX-LPA-LPA2轴在抑制结肠癌细胞增殖中的协同作用,为研发结肠癌治疗新策略提供了理论依据。
北京师范大学生命科学学院张俊杰教授和张笑天副教授为本文的共同通讯作者。博士生龙洋为本文的第一作者,已毕业博士生王玉芹、博士生屈梦侠和张地也在该研究中作出贡献。该工作得到了国家自然科学基金面上项目及北京市自然科学基金项目等资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S0304383523001775