基因组的完整性被破坏是衰老及衰老相关疾病如肿瘤的驱动因素之一,而DNA损伤的累积是基因组稳定性下降的重要原因。DNA双链断裂(DNA double strand breaks, DSBs)在所有DNA损伤类型中最为严重,细胞应对DNA双链断裂主要有两条修复通路,一条为同源重组(Homologous recombination, HR)修复,另一条则是非同源末端连接(Non-homologous end joining, NHEJ)修复。NHEJ可进一步分为经典非同源末端连接(canonical non-homologous end joining, c-NHEJ)通路和替代型非同源末端连接(alternative non-homologous end joining, alt-NHEJ)通路。NHEJ修复的缺失会加速细胞衰老,并且NHEJ修复与肿瘤的发生发展以及肿瘤细胞的放化疗抵抗关系密切。早期研究认为在c-NHEJ缺陷的细胞中,alt-NHEJ才会发挥作用。然而,在某些生物学过程中,即使c-NHEJ亚通路完整,alt-NHEJ也可能参与其中,这表明在特定情况下可能存在调节c-NHEJ和alt-NHEJ平衡的机制。虽然DNA修复领域在关于c-NHEJ和HR修复通路选择的机制方面取得了很大进展,但对于机体如何选择两种NHEJ亚通路的研究尚未得到足够的关注 (1-4)。
环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase, cGAS)是重要的胞浆DNA识别受体,其经典功能是通过cGAS-STING-TBK1级联信号参与先天免疫应答反应。然而,近年来多篇文章研究发现cGAS亦存在于细胞核中,参与多项生物学过程,包括可以在核内发挥其经典免疫功能等。我们前期的工作表明了核内cGAS通过抑制HR修复导致基因组不稳定增加并最终促进肿瘤的发生(5),亦有研究发现核内cGAS可能充当DNA复制减速器以及抑制有丝分裂染色体末端融合从而稳定基因组 (6, 7)。关于cGAS的核内新功能以及对基因组稳定性的调控机制仍有待被进一步探究。
2024年4月25日,同济大学生命科学与技术学院毛志勇教授团队在Cell Death & Differentiation在线发表了题为The cGAS-Ku80 complex regulates the balance between two end joining subpathways的工作。该研究发现,当DNA发生双链断裂时,核中cGAS与Ku80发生相互作用,一方面,增加DNA-PKcs的蛋白稳定性进而促进c-NHEJ修复,另一方面,通过降低Polθ转录从而抑制alt-NHEJ修复。该团队亦发现数个与肿瘤相关的cGAS突变体丧失了对c-NHEJ的促进作用,提示cGAS对c-NHEJ的调控在肿瘤的发生发展中起重要作用。此外,过表达cGAS使HR缺陷的乳腺癌细胞生存率显著降低,这也为HR缺陷的肿瘤病人的治疗提供了新的靶标。

在该项工作中,团队成员为了研究cGAS对NHEJ两条亚通路的调控,首先分别检测了cGAS对c-NHEJ和alt-NHEJ修复效率影响。通过EdU以及细胞周期检测实验证明G1期细胞的DNA双链断裂主要由c-NHEJ所修复;通过染色质免疫共沉淀(ChIP)实验证明cGAS可以到达G1期细胞的DNA双链断裂损伤位点处,提示cGAS极有可能参与c-NHEJ。于是,团队成员利用检测NHEJ修复效率的报告载体,通过流式分析发现cGAS显著促进c-NHEJ修复效率。有趣的是,利用检测alt-NHEJ修复效率的EJ2报告载体,发现过表达cGAS显著抑制alt-NHEJ修复效率。机制上,通过Western blot以及co-IP实验发现cGAS可促进去泛素化酶USP7与DNA-PKcs的互作从而增强DNA-PKcs的蛋白稳定性。进一步机制研究显示cGAS和USP7竞争性地与Ku80结合,使得更多的USP7与DNA-PKcs发生相互作用,从而维持DNA-PKcs蛋白的稳定性,促进c-NHEJ修复。其次,qPCR实验结果表明cGAS显著抑制alt-NHEJ通路中重要蛋白Polθ的转录水平;此外,ChIP实验结果表明,cGAS能够被募集至Polθ启动子区域。研究团队进一步对37个肿瘤相关的cGAS突变体进行c-NHEJ修复效率的检测,发现多个突变体丧失了对c-NHEJ的促进作用,提示cGAS对c-NHEJ的调控在肿瘤的发生发展中起重要作用;此外,过表达cGAS显著降低了BRCA1缺失的乳腺癌细胞的生存率,为治疗HR缺陷乳腺癌提供了新的靶点。
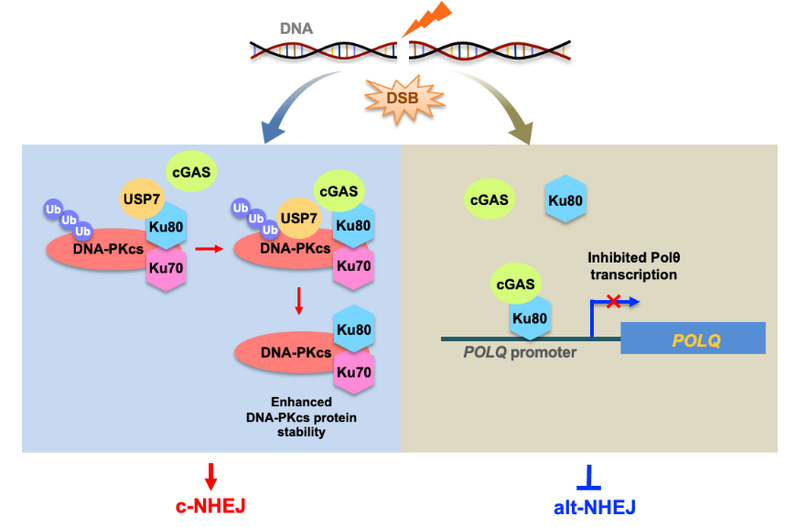
综上所述,该团队发现核中cGAS调控DNA双链断裂修复又一全新的功能,揭示了cGAS调控NHEJ两条亚通路的平衡的分子机制。值得一提的是,该研究不仅是对同济大学戈宝学/毛志勇教授团队在《Nature》论文“Nuclear cGAS suppresses DNA repair and promotes tumorigenesis”的延伸,也是对cGAS在DNA修复以及基因组稳定性调控方面的重要补充。
同济大学附属妇产科医院的助理研究员张海萍和生命科学与技术学院博士研究生蒋丽君为本论文的共同第一作者。同济大学生命科学与技术学院毛志勇教授、蒋颖副教授以及同济大学附属妇产科医院的吴桂珠主任为本文的共同通讯作者。同济大学医学院的硕士研究生杜心怡以及同济大学附属妇产科医院的技术员钱桢也参与了该项工作。