服务热线
178 0020 3020
ADC药物是指单克隆抗体通过共价链接子(linker)和细胞毒小分子载荷(payload)链接,实现靶向给药,截止目前共有11款ADC药物获批上市。
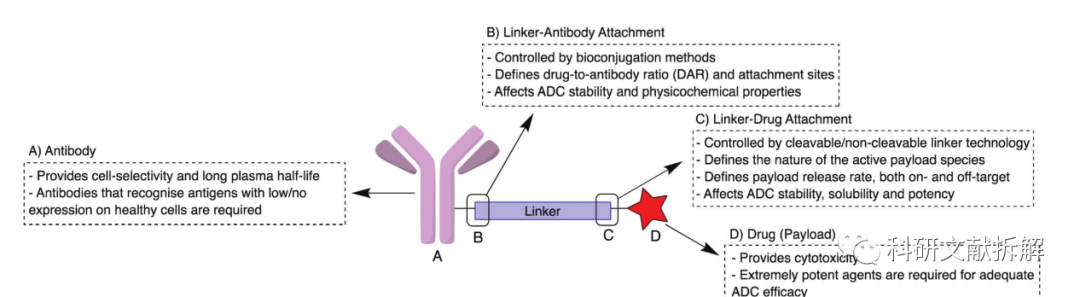
ADC药物靶向治疗机制
1:传统机制(A)
抗体结合到靶细胞表面的抗原;
通过内吞进入溶酶体,溶酶体中的酶或者酸降解ADC,释放载荷;
细胞毒载荷杀死肿瘤细胞,实现高选择性抗肿瘤;
有些情况,载荷具有很强的渗透性,可以扩散到细胞外,杀死旁观者肿瘤细胞。
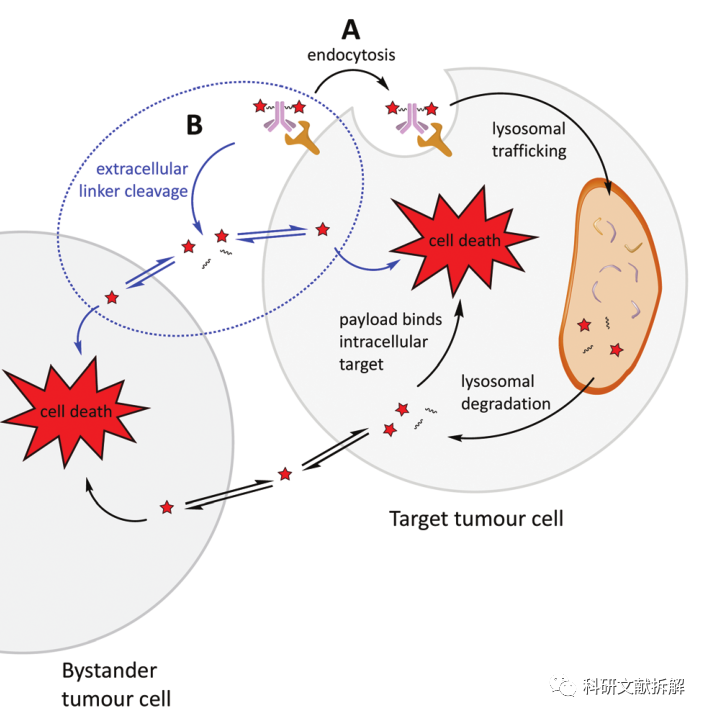
2:非内化机制(B)
linker作为mAb和payload的链接片段,对药物的毒性和活性起到至关重要的作用,通常理想的linker需要满足:
体内运输扩散具有足够的稳定性
需要很高的水溶性可以促进生物偶联,避免不溶性聚集体导致失活。
具有足够的消除活性,以便在靶点位置高效释放载荷。
linker的种类和裂解方式
目前常见的linker按照裂解方式可以主要分为化学裂解和酶裂解两大类。
一、化学裂解linker
1:酸裂解类
这一类的linker需要在血液运输的环境中稳定(PH=7.4),进入细胞中的內酶体(PH=5.5-6.2)和溶酶体(PH=4.5-5.0)中的酸性环境,被酸催化水解切除。
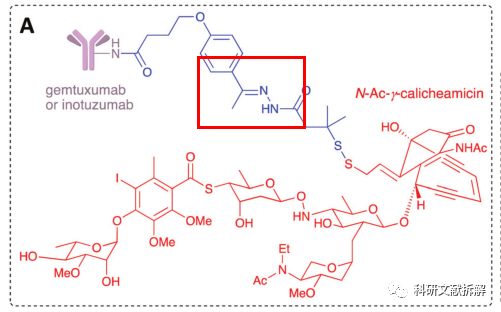
Mylotarg中的腙被酸性水解为酮和肼,有效切除连接片段,释放药物,该ADC中也使用了二硫键。
另一种常用的酸条件水解的结构还有碳酸酯类linker。
简单的碳酸酯在血清中的稳定性有限,需要加入一个对氨基苄基(PAB)可以显著提高半衰期。
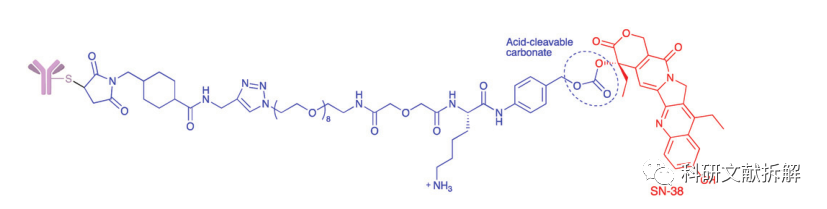
碳酸酯结构在酸性条件下水解释放SN-38药物和二氧化碳。
2:二硫键化学裂解
二硫化合物在生理PH条件下稳定,但是容易受到硫醇的亲核进攻,从而切断链接。
血浆中,主要的硫醇来自还原的HSA,不过这些大分子中的巯基通常被掩埋在立体结构中,反应活性很差。
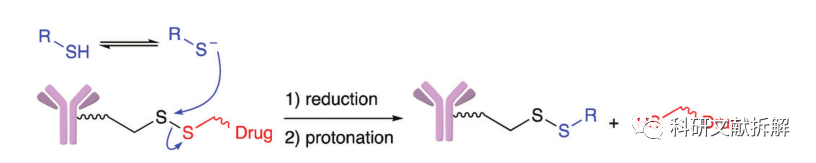
而胞浆中含有大量的谷胱甘肽(GSH),并且癌细胞中的GSH浓度会更高,GSH中的亲核巯基可以高效率切断二硫键。
2.1 位阻二硫键
二硫键的稳定性容易受到α位取代基的影响,进而影响ADC的生理活性。
Maytansinoid-ADCs 是靶向HER2+的ADC药物,研究者探索了在二硫键的α位存在甲基取代基时二硫键消除的活性。
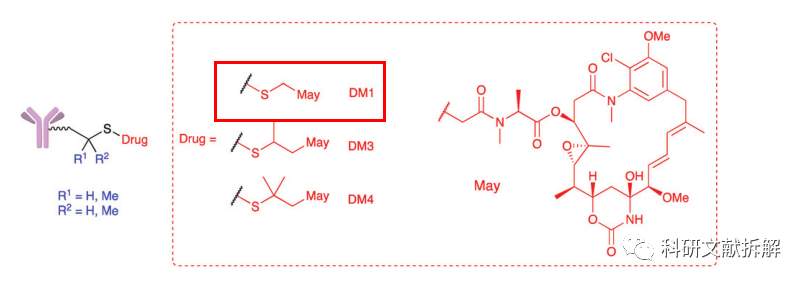
发现当取代基增加时,二硫键变得非常惰性。
没有取代基的二硫键易于断裂,两个取代基的二硫键难以释放药物,最终只有单取代结构才发挥出最大药理活性(R1=H,R2=Me,DM1)。
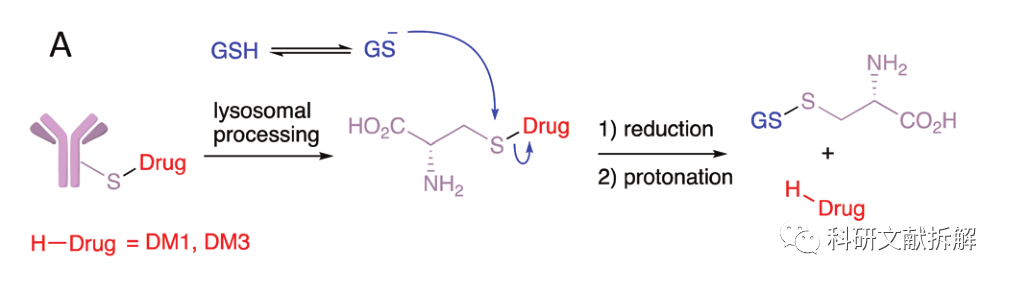
2.2 抗体载荷直接相连的二硫键
抗体上自带的半胱氨酸和Maytansinoid上的硫醇可以直接形成无额外linker结构的二硫键。
一些被抗体大分子包围的位点,可以保证稳定性和载荷的高效释放,不需要优化邻位取代基位阻。
此外MMAE上使用的氨基甲酸酯链接二硫键,也可以高效释放载荷,并且极大的扩展了可用于二硫键链接的小分子载荷范围。
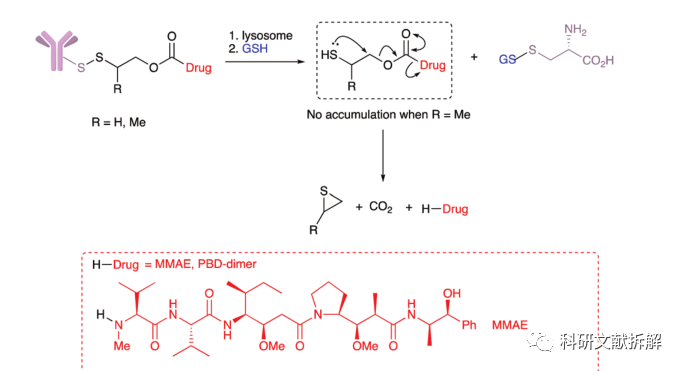
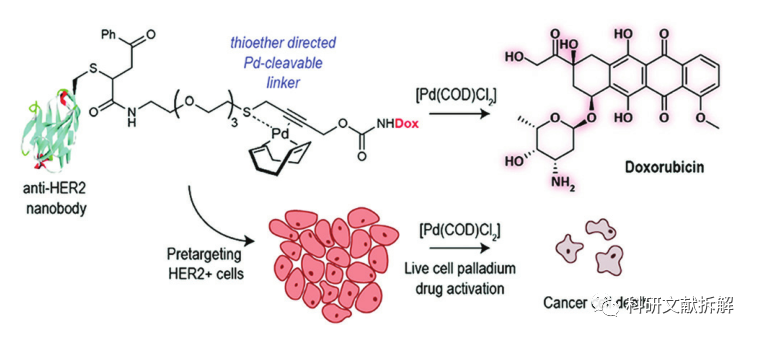
3:外源物引发消除
含有硫醚键的ADC药物,当在HER2+细胞中测试时,ADC的效力低于Doxorubicin本身,但在[Pd(COD)Cl2]降解试剂存在下的效力相同。
二、酶裂解类
细胞内的溶酶体和细胞外的肿瘤微环境中均存在特异性的酶可以选择性裂解相应的底物。
2.1 组织蛋白酶裂解二肽
二肽类的linker通常以组织蛋白酶B作为靶标,组织蛋白酶主要存在溶酶体中,在细胞外也观察到活性。
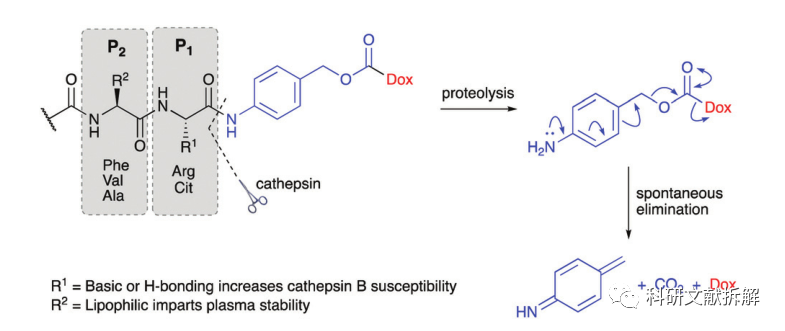
这些二肽的结构需要满足在P1位有亲水性残基,P2处有疏水性残基,这样可以被蛋白酶水解,同时保持linker在血浆输送过程中的稳定性。
doxorubicin的ADC需要在二肽之间增加一个间隔单元,对氨基苄基甲酸酯(PABC)。在酶切除二肽后PABC很快发生自身降解,释放原型Dox药物。
2.2 糖苷酶裂解
β-葡萄糖醛酸酶是糖苷酶类中的水解酶,催化多糖中β-葡萄糖醛酸残基的分解。
含有PABC的葡萄糖醛酸单元已经被研究,该类结构在血浆中的稳定性大于二肽,可以有效释放原型载荷。
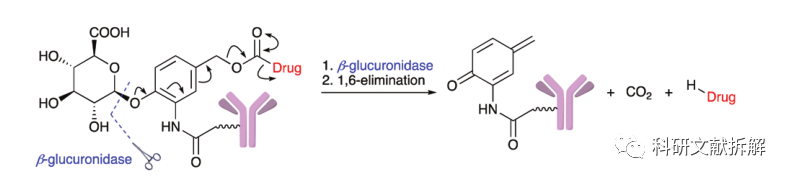
葡萄糖醛酸连接子还有一个优势,由于其很高的亲水性,可以大大减少ADC的聚集,这样可以合成高负载载荷的ADC药物(DAR=8)。
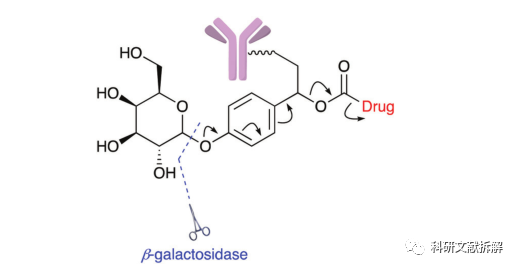
β-半乳糖苷酶可裂解接头和葡萄糖醛酸酶类似。
3:磷酸酯酶裂解
溶酶体中存在酸性焦磷酸酶和酸性磷酸酶,可以水解磷酸酯键。
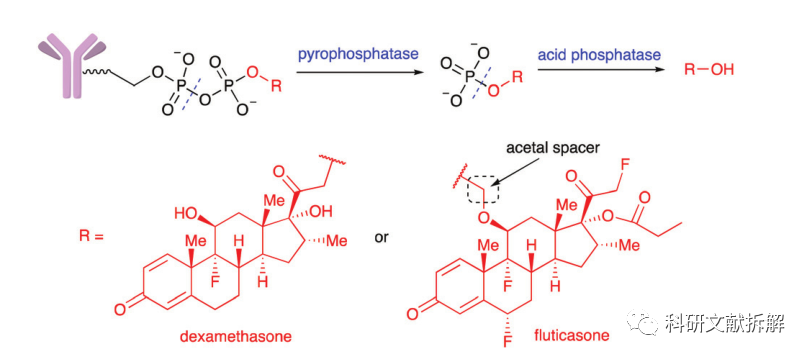
Merck设计了一种二磷酸酯linker,在溶酶体中水解释放原型糖皮质激素类载荷,当测试单磷酸酯链接子时,药物释放相对减缓。
总结
目前绝大多数ADC使用二硫化物或二肽,因为它们能够有效区分血浆和靶细胞条件。这两种技术现在都很成熟,并正在进一步开发,以更好地解决溶解性、血浆稳定性和释放官能团的能力
附件